01 溶瘤病毒疗法行业概况
1.1 定义
溶瘤病毒(oncolytic virus OVs),“溶瘤”即将肿瘤“溶解”(也就是杀死),它是一类新的治疗药物,可通过选择性杀伤肿瘤细胞和诱导全身抗肿瘤免疫的双重作用机制实现抗肿瘤效果。溶瘤病毒治疗癌症的基本思路是:将天然或经过基因重组的病毒,选择性地感染癌细胞,通过病毒自身的复制杀死并裂解癌细胞,释放出的病毒继续侵入癌细胞发挥作用。与此同时,癌细胞裂解后释放的肿瘤抗原便能够引起免疫应答反应,引导免疫系统对其他癌细胞甚至远端病灶展开攻击。溶瘤病毒是一个功能分类,并不是一个生物学分类,至今用于溶瘤治疗的病毒高达数十种。
根据其是否进行过改造,主要可以分为两类:一类是经过基因重组优先在肿瘤细胞内进行增殖的病毒 ,主要有单纯疱疹病毒、腺病毒、麻疹病毒以及牛痘病毒等;另一类则是野生型病毒株和天然的弱毒病毒株 ,比如呼肠孤病毒,新城疫病毒和副痘病毒等。
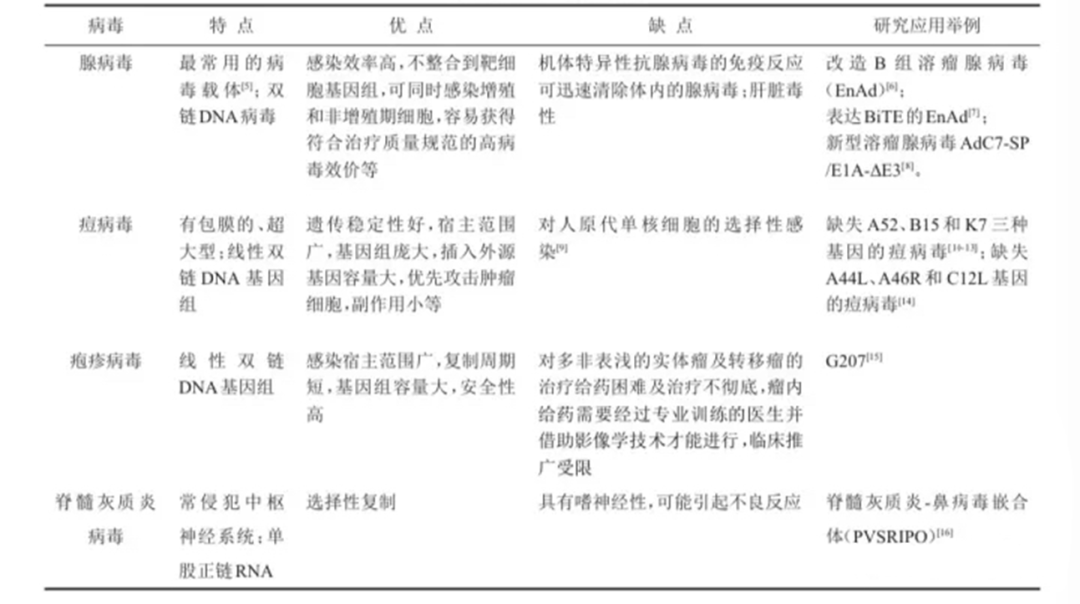
图表1:常用溶瘤病毒比较 (资料来源:生物世界,智银医药资料库)
与其他肿瘤免疫疗法相比较,溶瘤病毒具有杀伤效率高、靶向性好、不良反应小、多种杀伤肿瘤途径、避免耐药性以及成本低廉等优势。
溶瘤病毒可以在不同类型的肿瘤和不同进展阶段的肿瘤,甚至在转移性和无法治愈的癌症中提高总的生存率。对于晚期癌症病人,溶瘤病毒疗法被认为是挽救生命重要的手段之一,而且溶瘤病毒治疗能够诱导达到完全消退或缓解。
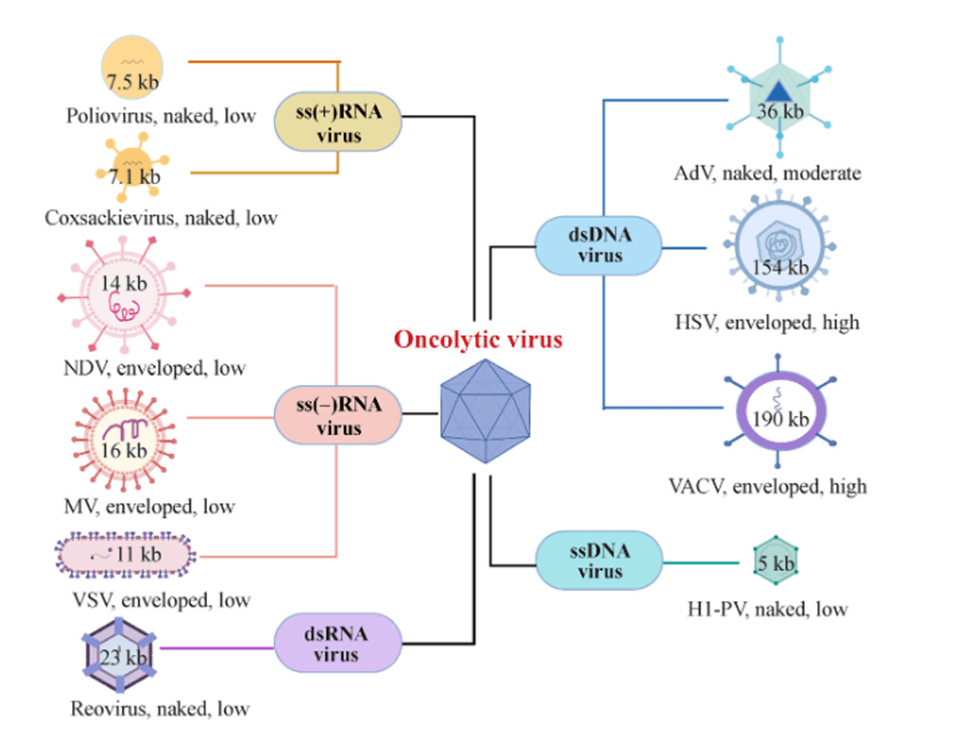
图表2:适用于肿瘤治疗的几种溶瘤病毒示意图 (资料来源:Front Med,智银医药资料库)
1.2 作用原理
1.2.1 基本原理
2019年美国癌症研究协会(American Association for Cancer Research, AACR)在其年度抗癌报告中将溶瘤病毒归类为继手术、放疗、化疗和靶向治疗后,新的免疫治疗方法。
该疗法摒弃了传统手术治疗容易造成患者创口大、易感染,及放射治疗过程中杀敌一千、自损八百的敌我不分和化学药物治疗过程中极易产生耐药性,副作用明显等治疗短板,将个性化靶向治疗方法真正的应用到临床。
目前大多数溶瘤病毒的开发都是基于野生型病毒的改造,当然包括应用最大的腺病毒或腺相关病毒的重塑。但无论如何改变,溶瘤病毒对肿瘤细胞的杀伤机制都基本概括为以下三点:
溶瘤病毒通过病毒特异性受体介导的机制进入细胞。通常,在肿瘤细胞上高度表达特定的病毒进入受体;另外,还有通过重新靶向溶瘤病毒以通过肿瘤特异性受体进入细胞来改善肿瘤选择性的努力。
与正常静止细胞相比,肿瘤细胞具有高代谢和复制活性,快速的细胞分裂增加了病毒复制。此外,肿瘤驱动突变特异性地增加了肿瘤细胞中病毒复制的选择性,且许多肿瘤细胞具有抗病毒I型干扰素信号传导的缺陷,因此支持选择性病毒复制。
肿瘤微环境中病毒复制会促使先天免疫和适应性免疫激活,这种激活限制了病毒在正常细胞中的传播。重要的是,病毒的存在以及细胞裂解、肿瘤抗原的释放和危险相关的分子模式,可以克服肿瘤微环境中的免疫抑制并促进抗肿瘤免疫。
众所周知,肿瘤不只是一大团癌细胞无规则的聚集在一起,而是一个复杂的系统。里面不仅仅有癌变的细胞,还有很多共生的正常细胞,比如血管细胞,免疫细胞等,正常细胞和癌细胞之间相互作用,相互影响。
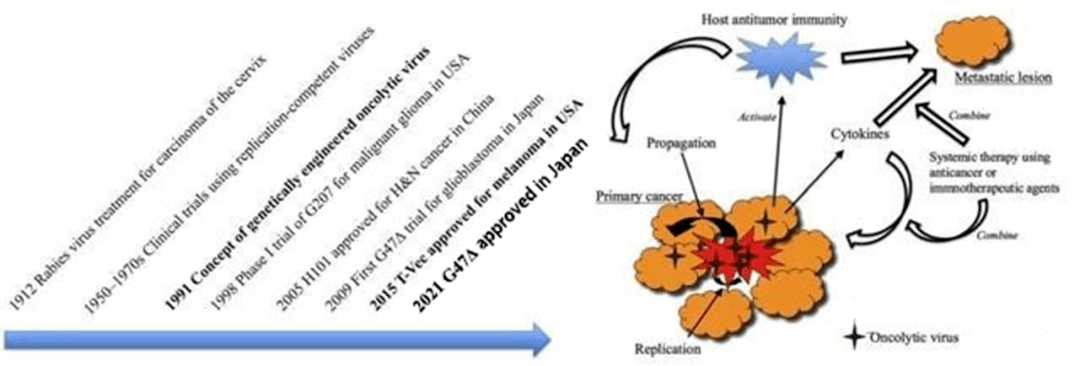
图表3:溶瘤病毒疗法的发展及作用机制 (资料来源:生物谷,智银医药资料库)
1.2.2 “冷肿瘤”与“热肿瘤”
免疫细胞是最常见的、与癌细胞共生的正常细胞类型。如果浸润肿瘤组织中的免疫细胞多,那么这个肿瘤就是“热肿瘤(hot tumor)”,反之则是“冷肿瘤(cold tumor)”。大家之所以这么关心癌细胞的冷热,是因为现在很受追捧的“免疫检查点抑制剂疗法”对“热肿瘤”有用,而对“冷肿瘤”基本无效。
因为热肿瘤中已经存在免疫细胞,尤其是T淋巴细胞,但是这些T细胞已经被肿瘤细胞结合并束缚,而免疫检查点抑制剂能够解除肿瘤对T细胞的“刹车”效应,这些被释放的T细胞能够迅速动员,快速杀伤肿瘤细胞。
而对于“冷肿瘤”来说,免疫细胞很难识别并杀伤,免疫检查点阻断剂也就很难发挥功效。从这一点出发,对于有极少肿瘤浸润性T淋巴细胞(TIL)附着的“冷肿瘤”来讲,通过抗原暴露的方式激活全身免疫,招募高水平的肿瘤浸润性T淋巴细胞包围肿瘤细胞,使“冷肿瘤变热”,无疑是溶瘤病毒最好的抗肿瘤方式。
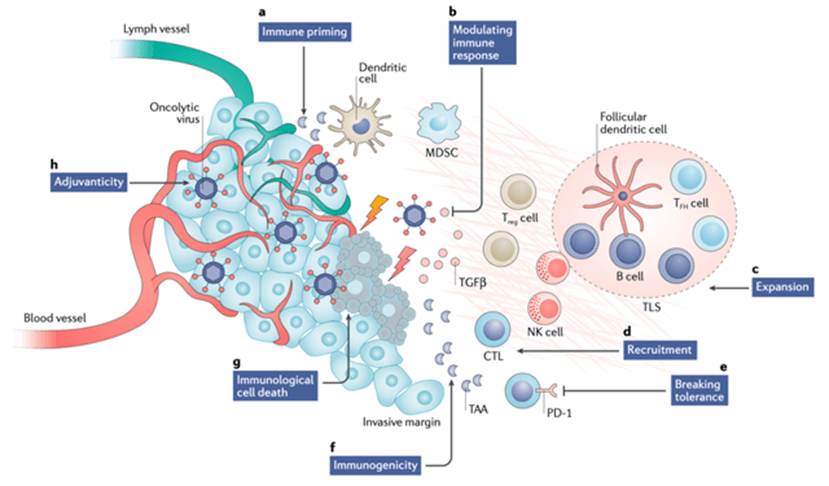
图表4:免疫性冷肿瘤的治疗方式概述图 (资料来源:Nature Reviews Drug Discovery volume,智银医药资料库)
1.2.3 表位扩张效应与良好预后
在细胞免疫过程中,依据抗原表位刺激机体免疫应答的强弱,可将其分为两类:
(1)优势表位(dominant epitope) ,其具有强免疫原性,在刚开始接触免疫细胞时,可首先激发免疫反应;
(2)隐蔽表位(cryptic epitope),其隐藏于抗原大分子内部或密度较低,在后续应答过程中,才可激活免疫细胞。
据发现,特定抗原刺激机体后,免疫系统首先针对优势抗原表位产生应答,但往往尚不足以清除该抗原,随着免疫应答过程的持续,机体可相继针对更多抗原表位(包括隐蔽表位)产生应答,而整个免疫反应也随之增大,此现象称为表位扩张(epitope spreading)。
良好的预后是临床实验期望的结果。肿瘤组织经溶瘤病毒处理后,能够激发局部的甚至是全身性的免疫反应,进一步攻击肿瘤残存碎片,通过表位扩张现象清除隐藏或发生转移的肿瘤细胞,使患者预后良好,达到不再复发或者恶化转移的目的。
当然,表位扩展的过程中更多的需要我们临床医生依据临床表现做出适当的药物或人为干预,以防诱发自身免疫疾病。Kaufman等人于2016年综述了目前已知的溶瘤病毒在人体肿瘤细胞中复制并激活局部及全身免疫反应的分子细节。即溶瘤病毒的治疗功效取决于直接的细胞裂解作用和间接的抗肿瘤免疫反应激活这两者的结合。
肿瘤细胞一旦感染溶瘤病毒后会启动由内质网(endoplasmic, ER)应激和遗传毒性应激组成的抗病毒反应。这种反应导致活性氧(reactive oxygen species, ROS)的上调和抗病毒细胞因子产物的启动。ROS和细胞因子,特别是(I型干扰素(type I interferons, IFNs)会从被感染的癌细胞中释放出来并激活抗原递呈细胞antigen presenting cells, APC)、CD8+ T细胞和自然杀伤性(natural killer, NK)细胞等免疫细胞。
紧接着,溶瘤病毒积累到一定量后,产生溶瘤效应,释放病毒后代,进一步释放病源相关分子模式,危险相关分子模式信号以及包括新抗原在内的肿瘤相关抗原。其中,释放的病毒后代通过传播继续感染其他肿瘤细胞。
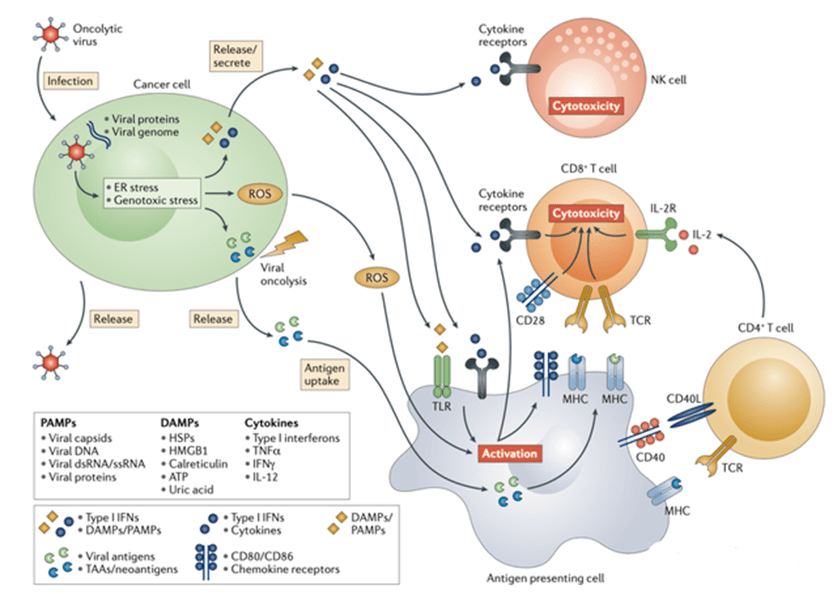
图表5:溶瘤病毒诱导局部和全身抗肿瘤免疫 (资料来源:Nature,智银医药资料库)
1.3 发展历程
实际上,OVs的发现已经有百年历史,大致可分为3个阶段:野生病毒株发现应用阶段(1904-1990年)、基因改造病毒株研发阶段(1991-2000年)和基因插入及联合治疗增效阶段(21世纪)。
20世纪早期,不断存在病毒感染的肿瘤患者出现病情缓解或痊愈的案例,这引起了研究人员的好奇,随后便诞生了溶瘤病毒的概念及相关研究。
20世纪中后期,研究人员开始使用免疫接种或病毒感染的方式,进行癌症肿瘤治疗并取得一定成效。但由于当时技术有限,临床主要都是采用天然弱病毒株(水痘病毒、麻疹病毒等),这类毒株对肿瘤细胞杀伤能力有限,容易激活宿主免疫系统被清理,还易引发相关的并发症,研究人员难以有效控制病毒病原性。而当时,化疗和放疗又显示出了颠覆性的疗效,使得溶瘤治疗被忽视,研究跌入低估。
20世纪晚期,随着病毒学和基因工程技术的不断发展,研究人员能够对病毒基因进行改造,这大大提高了溶瘤病毒在肿瘤治疗方面的效果、特异性和安全性。之后,溶瘤病毒就开启了肿瘤治疗的新纪元。
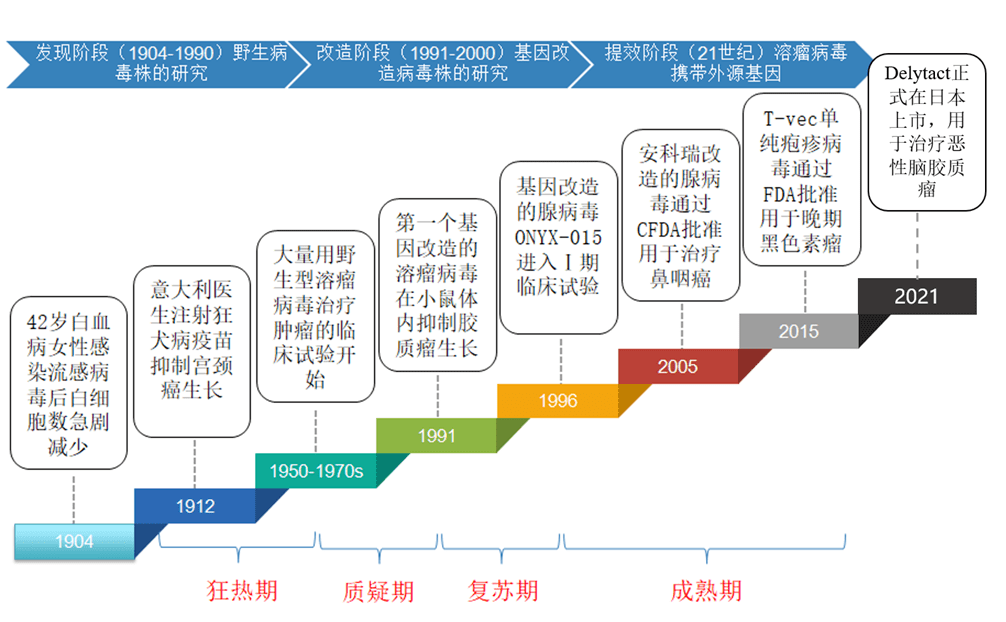
图表6:溶瘤病毒发展历程 (资料来源:健康界,智银医药资料库)
进入21世纪,截至2021上半年,全球已有至少四款溶瘤病毒疗法获批上市,分别为rigvir(ECHO-7病毒)、安柯瑞(重组人5型腺病毒)、T-Vec(单纯疱疹病毒),Delytact。
1998年美国基于HSV-1再次深度开发为G207试用于恶性神经胶质瘤I期临床试验(Whisenhunt et al 2015),再到2009年日本基于HSV-1开发的第三代溶瘤病毒G47Delta开展针对胶质母细胞瘤的I期临床试验(Fukuhara et al 2005)。
2015年被美国食品药品监督局(U.S. Food and Drug Administration, U.S. FDA)批准美国安进(Amgen)公司上市的基于HSV-1(1型单纯疱疹)病毒基因改造产品 T-VEC(talimogene laherparepvec)(随后被欧盟批准上市),是第一个获批应用于临床的靶向黑色素实体瘤治疗的溶瘤病毒,可明显延长患者的总生存期,这标志着溶瘤病毒治疗已经走向成熟。
T-VEC 的开发是基于皮肤和淋巴结有转移性黑色素瘤损伤患者的三期临床试验,通过可致唇疱疹的1型单纯疱疹病毒(HSV-1)共表达免疫激活蛋白粒细胞-巨噬细胞集落刺激因子(GM-CSF)经瘤体内注射,感染肿瘤细胞并在其内复制、裂解癌组织,并激活全身免疫反应的过程,主要用于治疗转移性,经手术无法祛除的黑色素瘤,属第二代HSV-1产品。
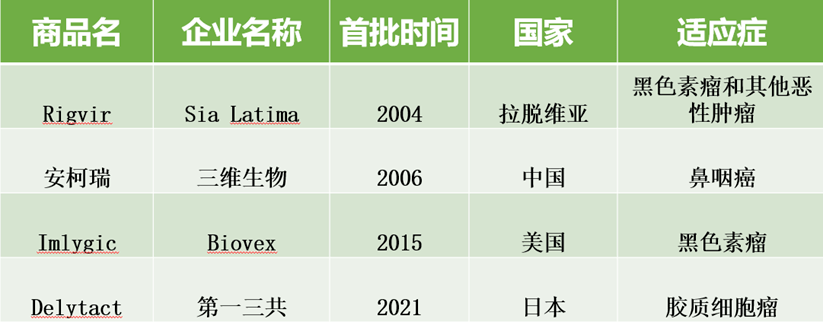
图表7:已上市溶瘤病毒 (资料来源:智银医药资料库)
1.4 溶瘤病毒常见种类
溶瘤病毒疗法基于病毒的细胞裂解能力对肿瘤细胞进行杀伤,有多种常用病毒并可通过基因编辑技术进行修饰以提高靶向效率。
病毒因其天然的细胞裂解功能,是杀伤肿瘤细胞的有效选择。从最初的天然病毒到经过基因编辑的病毒,溶瘤病毒的种类也从最初的疱疹病毒发展到十多种常用的病毒,其中腺病毒以其基因编辑的简易性和使用的灵活性成为了最为常用的溶瘤病毒。
其它常用的病毒包括单纯疱疹病毒、牛痘病毒、新城疫病毒、麻疹病毒、呼肠孤病毒、柯萨奇病毒、脊髓灰质炎病毒等。溶瘤病毒的种类跨越单链到双链,从RNA到DNA,从天然到基因编辑,极大地提升了该疗法的在实体瘤临床治疗中的灵活性。
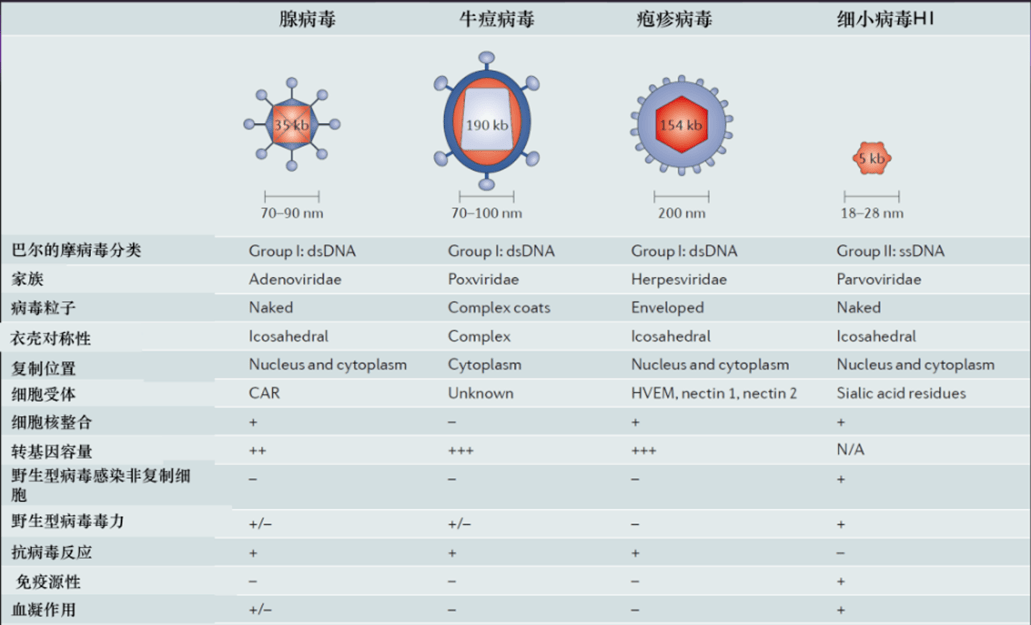
图表8:主要的溶瘤病毒对比 (资料来源:Oncoimmunology,智银医药资料库)
1.5 溶瘤病毒疗法与其它肿瘤疗法对比
溶瘤病毒疗法由于病毒独特的生物特性,对于实体瘤疗效显著,总体副作用较低,价格较其它创新疗法低,为肿瘤患者提供了新的治疗选择。
传统肿瘤疗法包括手术切除、化疗、放疗,对早期肿瘤具有较强的杀伤力,患者预期良好,但是对于中晚期患者通常疗效不佳,加之传统疗法的高侵入性和影响广泛的不良反应,该类疗法在中晚期患者治疗中的地位逐渐被新型免疫疗法所替代。
新型疗法涵盖了几个大类包括肿瘤免疫抗体药物、细胞基因治疗、溶瘤病毒疗法等。溶瘤病毒疗法的研究开发长期集中在实体瘤适应症,得益于其独特的生物特性,该疗法在实体瘤治疗上有着独特的优势。
在建立符合临床要求的安全性和有效性的基础上,溶瘤病毒疗法未来可能深入不同的血液瘤适应症,为广大患者提供新的治疗选择。
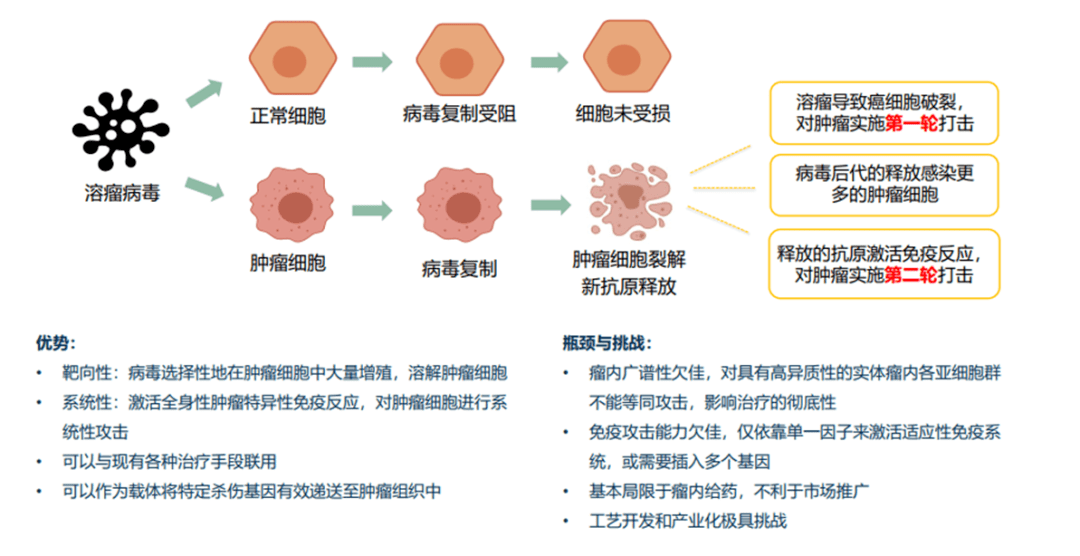
图表9:OV优劣势分析对比 (资料来源:智银医药资料库)
02 全球行业市场情况
2.1 抗肿瘤药物市场
2.1.1 全球发病人数
肿瘤已成为危害人类健康最严重的疾病之一,发病人数持续增加,死亡率高,当前传统肿瘤治疗手段仍存在许多未被满足的临床需求,溶瘤病毒疗法提供了新的治疗方式。
2020年,全球恶性肿瘤总发病人数达到1,929万人,随着人口老龄化、不良生活习惯以及社会环境因素的影响,预计肿瘤发病人数将持续增加,2025年发病人数将达到2,162万,2020至2025年复合年增长率为2.3%。
溶瘤病毒作为一种新型肿瘤免疫疗法,通过直接裂解肿瘤细胞或者抗肿瘤免疫反应达到杀伤肿瘤细胞的目的,而不影响正常细胞的生长,为广大恶性肿瘤患者带来希望。
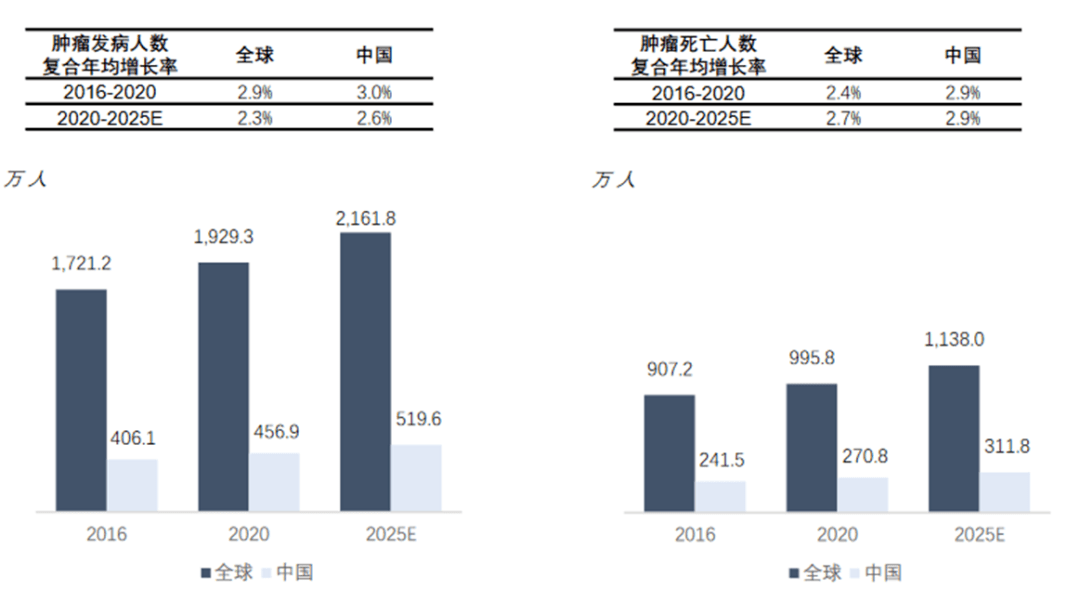
图表10:全球与中国肿瘤发病与死亡人数 (资料来源:沙利文,智银医药资料库)
2.1.2 抗肿瘤药物市场规模
全球及中国抗肿瘤药物市场近年来持续增长,随着肿瘤患者的增加以及肿瘤治疗技术不断创新,预计全球及中国抗肿瘤药物市场将进一步扩大。
受到全球癌症人口的增长以及前沿癌症治疗方法兴起的共同影响,全球肿瘤药物市场规模持续增长。截至2020年底,全球抗肿瘤药物市场规模为159.3亿美元,较上年增加15.8亿美元,同比增长11.01%;预计2021年全球抗肿瘤药物市场规模将达到177.9亿美元。

图表11:全球与中国抗肿瘤药物市场规模 (资料来源:智研咨询,智银医药资料库)
2020年,全球肿瘤药物市场以靶向药物为主,占比为60.4%,化疗及肿瘤辅助用药占比较低,肿瘤免疫治疗占比为23.4%。随着技术不断创新,肿瘤免疫治疗市场占比将扩大,2030年预计占比达到47.6%。
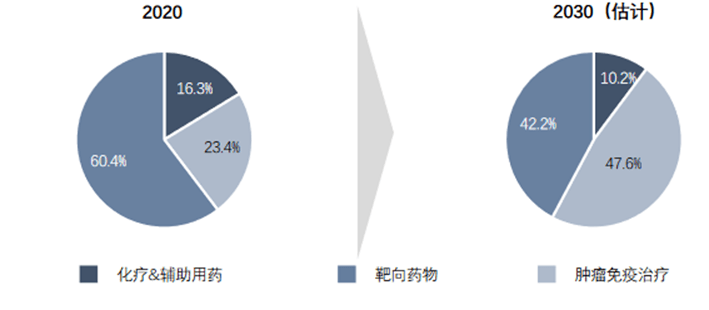
图表12:全球抗肿瘤药物市场拆分 (资料来源:沙利文,智银医药资料库)
2.2 溶瘤病毒市场
全球及溶瘤病毒行业市场规模在技术创新、政策利好及研发投入增长的背景下将快速扩增。
2016年至2020年,全球溶瘤病毒市场增长较缓。随着技术创新,更多溶瘤病毒产品商业化,预测未来溶瘤病毒市场规模有快速增长趋势,预计于2025年全球整体市场规模达到67.9亿美元,2020到2025年(估计)全球溶瘤病毒市场复合年增长率为171.2%。
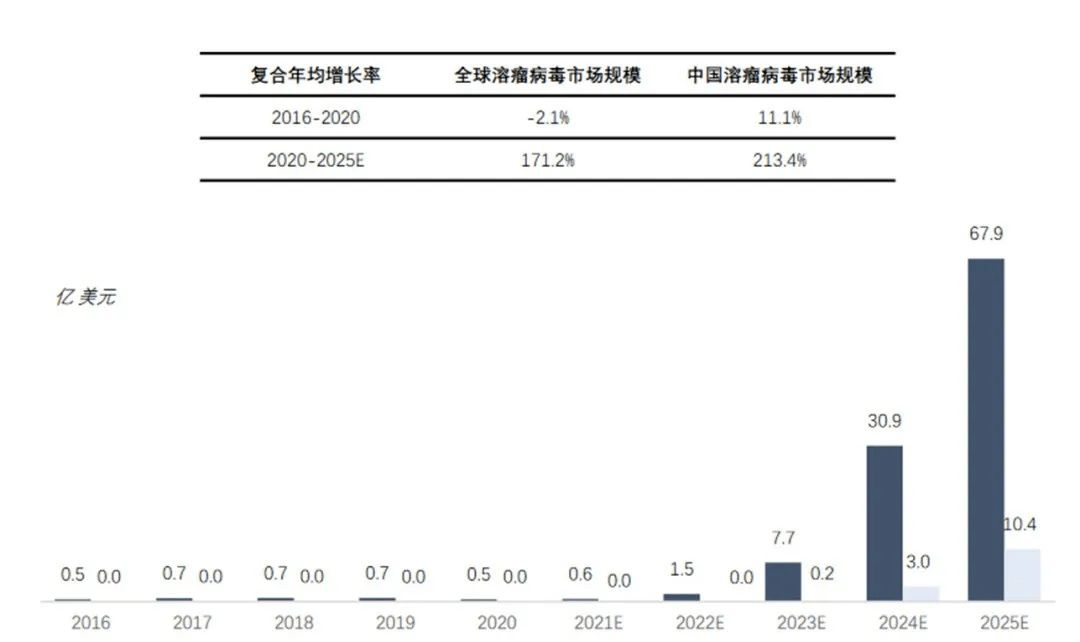
图表13:全球及中国溶瘤病毒市场规模 (资料来源:沙利文,智银医药资料库)
03 国内行业市场情况
3.1 肿瘤方面
3.1.1 中国发病人数
2020年,中国恶性肿瘤总发病人数约为457万人,预计未来肿瘤发病人数将不断增加,2025年将达到520万,2020至2025年复合增长率为2.6%。2020年,中国恶性肿瘤死亡人数约271万人,预计2025年达到312万人。在患者增加以及肿瘤领域大量未被满足的临床需求推动下,溶瘤病毒疗法市场将不断扩大。
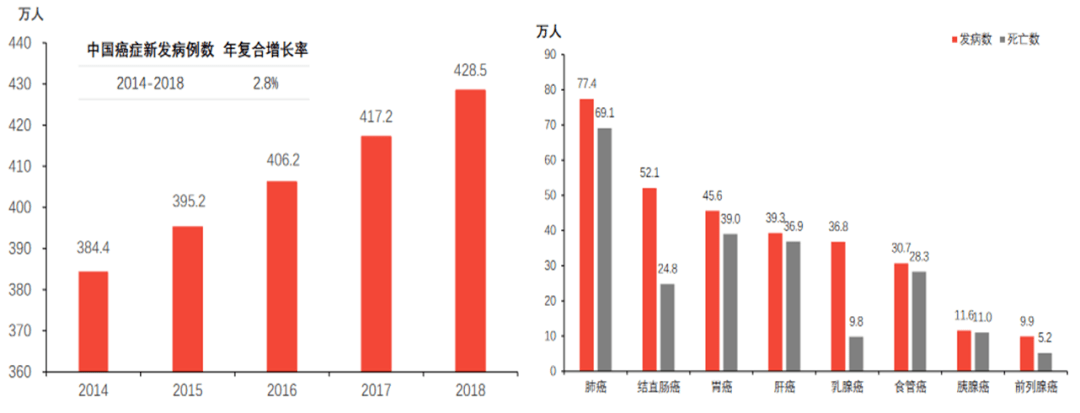
图表14:中国肿瘤发病与死亡人数 (资料来源:《2018年全球癌症统计报告》,智银医药资料库)
3.1.2 抗肿瘤药物市场规模
肿瘤治疗技术的不断创新使得中国肿瘤治疗市场未来几年也处于上升态势。预计中国抗肿瘤药物市场在2025年将会达到603亿美元,年复合增长率为16.1%。
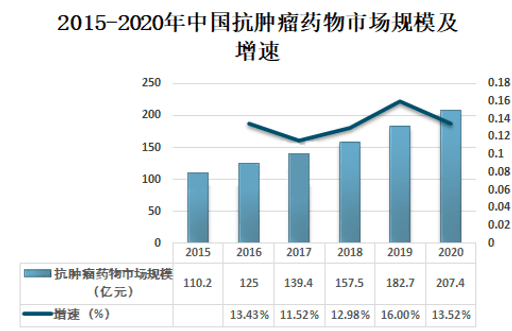
图表15:中国抗肿瘤药物市场规模 (资料来源:智研咨询,智银医药资料库)
目前,中国抗肿瘤药物市场中化疗及辅助用药占主导,达到总市场的63.4%。靶向药物占29.1%的比例,7.5%为肿瘤免疫治疗,滞后于全球市场。随着政策及监管体系的完善、技术不断成熟和患者负担能力提高,中国抗肿瘤药物市场将快速发展,预计2030年肿瘤免疫治疗将占据市场的39.9%,体现出未来肿瘤免疫治疗市场的巨大潜力。
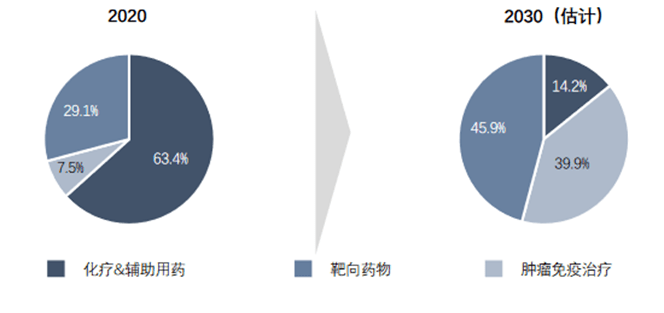
图表16:中国抗肿瘤药物市场拆分 (资料来源:沙利文,智银医药资料库)
3.2 溶瘤病毒方面
2016年至2019年,中国溶瘤病毒市场从2.7亿元增长到6.7亿元,复合年增长率为11.1%。预测未来中国溶瘤病毒市场规模快速增长,中国溶瘤病毒药物市场规模将以16.2%的年复合增长率继续保持增长,到2024年,市场规模有望上升至14.3亿元。
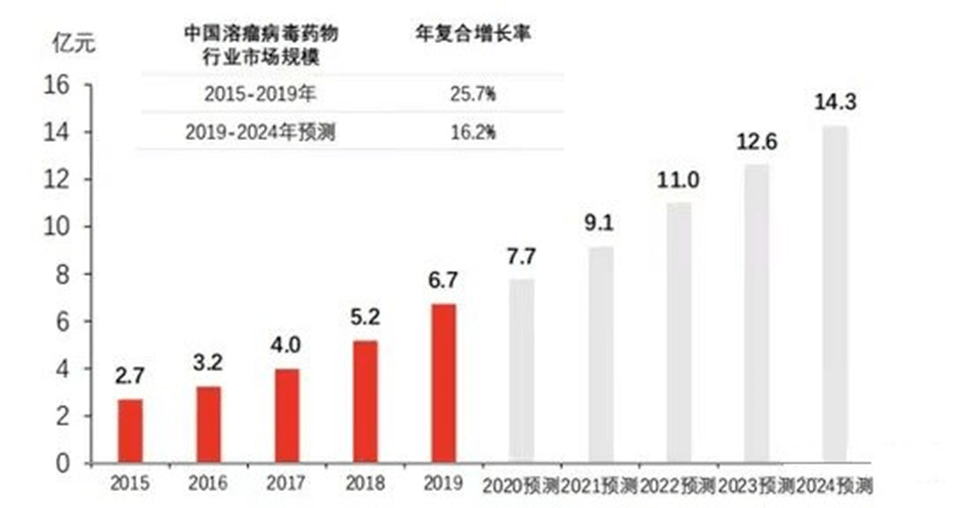
图表17:中国溶瘤病毒市场规模 (资料来源:头豹研究院,智银医药资料库)
3.3 市场驱动力分析
3.3.1 医药市场规模分析
中国是全球第二大医药市场,预计到2025年,中国医药市场规模将达到3,315亿美元,在全球市场份额的比重也将上升到19.4%。同期的中国复合年均增长率为9.6%,将超过全球复合年均增长率(5.7%)。预计2020年至2025年,中国医药市场的复合年均增长率将高于全球其他地区。
受到政策红利、大量的研发投入、人口红利等影响,未来中国医药市场占全球医药市场份额将持续上升,为溶瘤病毒产业发展带来充足的市场空间。
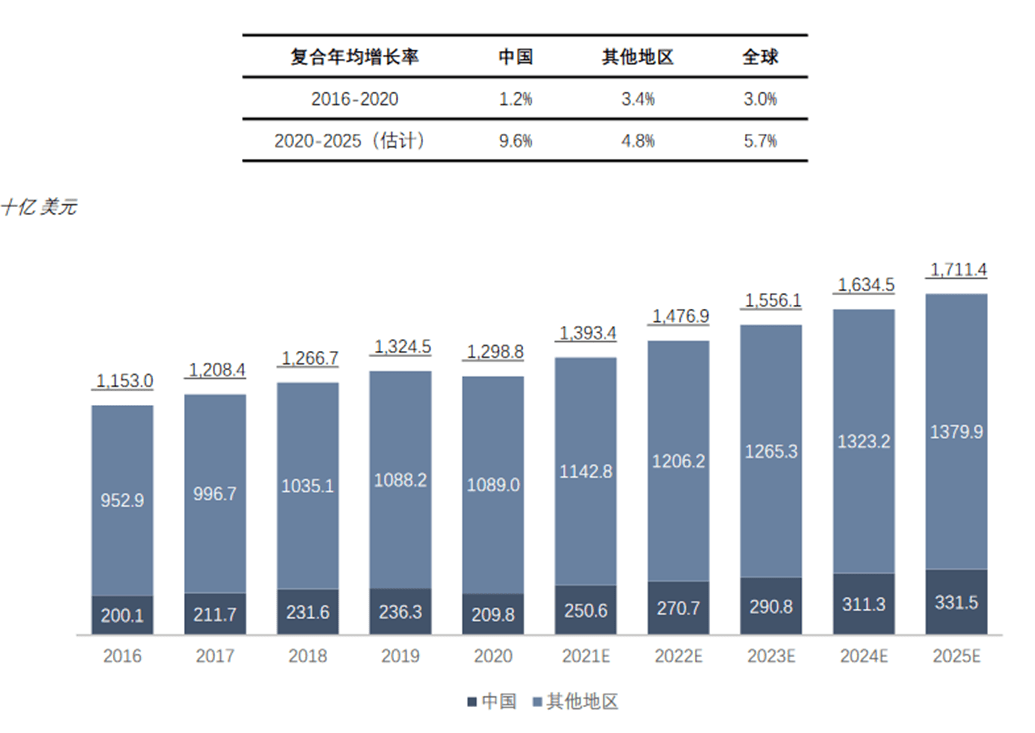
图表18:全球及中国医药市场 (资料来源:沙利文,智银医药资料库)
3.3.2 研发投入分析
由于患者需求的增长、相关政策的支持以及创新技术的推出,中国医药研发投入增速加快,将推动溶瘤病毒行业发展。
中国医药研发开支占营收比低于同期水平
2019年全球医药研发开支占营收比为13.8%,而中国市场占比仅为8.9%。随着政策和人才红利的推动,预计未来中国制药企业将加大创新药物研发开支,溶瘤病毒行业具有较大市场潜力与增长空间。
中国医药研发开支具有较大增长潜力,利于溶瘤病毒产业快速发展
2020年,中国医药研发开支为247亿美元,占全球总开支的12.1%。预计到2025年,中国医药研发开支将达到496亿美元,占全球医药开支比重的16.8%。同期复合年增长率为15.0%,为全球医药研发开支复合年均增长率的近2倍。
在利好政策背景下,研发开支的增长将推动溶瘤病毒的技术创新与临床转化,促进溶瘤病毒产业快速发展。
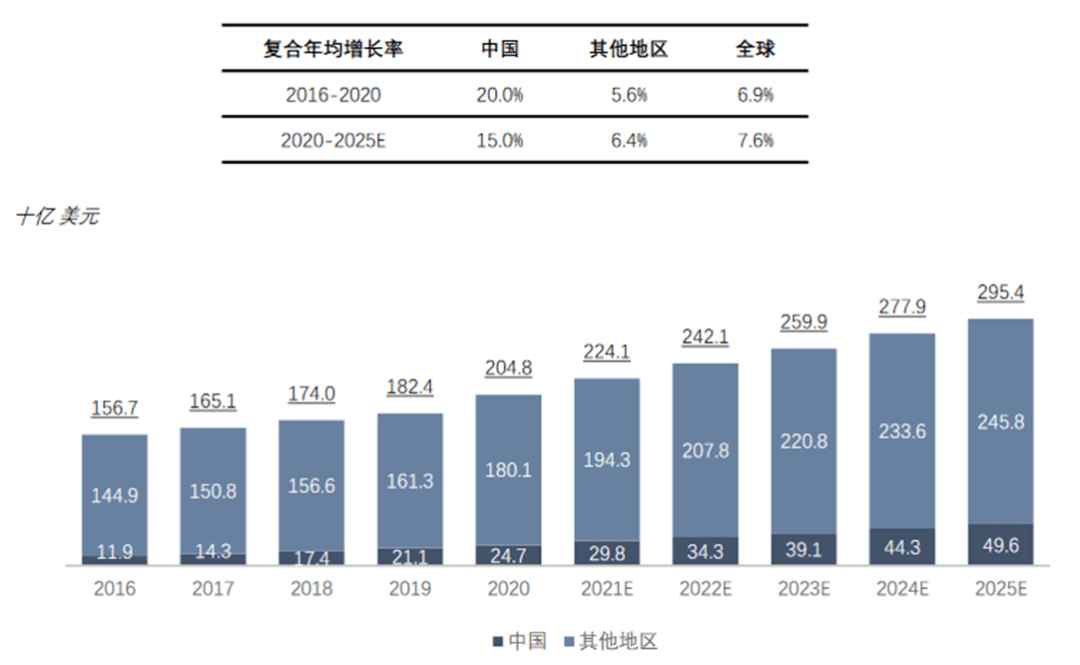
图表19:全球及中国医药研发开支 (资料来源:沙利文,智银医药资料库)
3.3.3 投融资分析
受政策、资金、人才支持,中国医药市场受资本市场的青睐。基因治疗包括OV行业成为中国资本投资热点,给予OV产业发展资金支持。
中国医药市场受资本市场青睐,预计未来资本投资仍会保持上升趋势但趋于理性
在2015年,中国医药市场投资金额为32亿美元,占全球投资额16.3%。到2019年,中国医药市场资本投资金额为50亿美元,同期全球市场为407亿美元,占比为12.3%。预计未来,中国和全球医药产业投资规模仍会增加。
医药投融资市场活跃,基因治疗包括OV领域热度升温
据中国基因治疗领域融资交易情况显示,2020年度基因治疗领域融资总金额约为101亿美元,2016年至2020年复合年增长率达到72.1%。2020年IPO和私募基金的金额显著增加。预计未来整个医药投融资市场仍会保持较高活跃度,基因治疗领域的资本投入不断增加,资本注入也将推动OV产业发展。
但同时溶瘤病毒药物行业面临科研投入风险、给药技术制约风险、政策性风险、病毒复制受限风险,以及技术替代风险等行业风险。
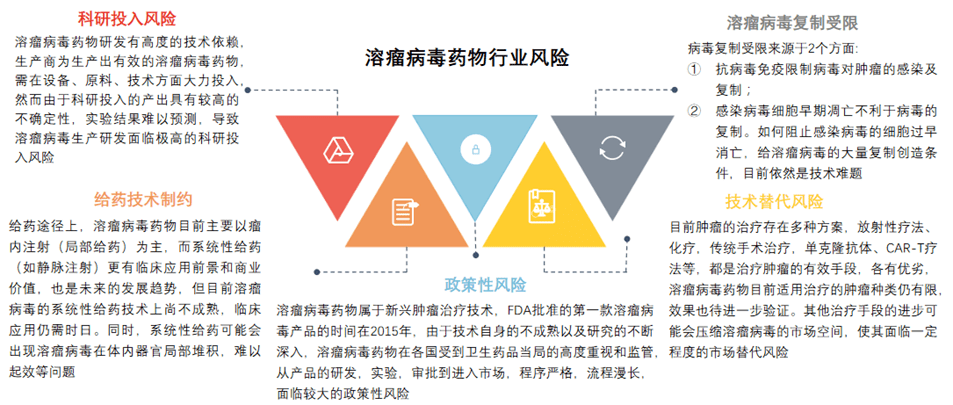
图表20:溶瘤病毒药物行业风险 (资料来源:头豹研究院,智银医药资料库)
3.3.4 CXO分析
OV相比传统药物研发投入多且研发生产难度较高,CRO/CDMO服务覆盖病毒构建及优化、规模化放大,纯化包装等OV研发生产流程中各阶段,推动OV产业快速发展。
OV研发生产费用及难度较传统药物更高,CXO帮助企业控制成本
OV在研发生产各个阶段的费用均超过传统药物,促使企业与成熟的CXO合作以期控制成本投入。近年来,兴起了一批拥有自主知识产权和核心技术的医药创新研发团队。
然而,这类小型或初创企业往往不具备生产所需的设施,缺乏生产相关的经验,其通常需要与CDMO公司合作完成项目的研究和开发。OV作为研发投入和难度较高的创新疗法,CXO通过成熟的生产工艺及设备提供病毒放大生产等服务,帮助企业控制成本,推动OV产业发展。

