2015年8月18日,国务院发布《关于药品医疗器械审评审批制度的意见》,标志着全方位强制性改革计划的启动。本文将按时间顺序回顾中国政府从2015年至今,在构建更加科学有效的药品监管体系方面所做的努力(见图1)。
我们从数百项重大政策、计划和公告中,选取了五大标志性文件或活动以及其它数十项意义最为重大的举措,并按主要目标和作用分为三类:以释放注册积压、提高药品审评审批效率为目标;以鼓励药品创新、提升药品质量为目标;以优化规定条例、 推动药品监管立法为目标。另外,此文还将展开讨论此次改革的两大阶段。
第一阶段:建立有效的制度
第一阶段改革的重点在于创建一个有效的审评监管制度。此项改革行动的主要内容包括消除严重药品注册申报积压(包括新药和仿制药的临床试验和上市申报),申报数量在2015年年中达到峰值,为22000个。
2015年7月22日,国家食品药品监督管理总局(CFDA)规定对1622个待审药物开展临床试验数据自查核查工作。这场彻彻底底的自查核查行动以波浪式方式推进,负责机构随即对其余待审药物的临床数据也展开了现场核查,核查数量约占2023个已向食药监总局申报待审药品注册申请的22%,扣除约3%免做临床试验和约 65%撤回申报的待审药品。
这轮加紧的改革行动彻底打击了数据造假,保证了数据真实性和完整性,并在2016年底前完成了对大量药品注册申报积压的清理目标。随后,国家又采取了新一轮措施以缓解积压、提高效率。食药监总局提高了药品注册费并增加了审评人员。
此外,化学药生物等效性试验备案管理的实施;基于临床价值的药品优先审评制度的建立;仿制药申报过剩的识别;有缺陷申报的驳回;加强药品审评中心(CDE)与药品赞助商之间的沟通上诉机制都陆续生效。最终,注册申报积压在2017年底得以基本消除。
造成严重注册积压的原因包括:5000多家药企扎堆在高度碎片化的低端仿制药市场,以及大量注册申报过剩。此外,法律体制规定只有中国本土药企才能申请并获得制药审批。不仅如此,对新药的宽泛定义也阻碍了真正创新的脚步。
为了解决这些问题,2015年11月4日,全国人大表决通过在10省市推行为期 3年的药品上市许可持有人(MAH)制度试点工作。该试点项目将药品生产许可持有人与上市许可持有人分离,让生产能力受限的研发机构和科研人员也能提交新药临床试验申报或新药申报。
2016年3月4日正式发布的化学药品注册分类将“新药”的定义从“中国新”改为“全球新”。不仅如此,新分类将“仿制药”标准上升为必须与原研药在质量和疗效上都相同。
第二阶段:鼓励创新
第一阶段(约从2015年5月到2017年5月)的改革举措为第二阶段铺平了道路,2017年5月11日和12日,食药监总局发布了四条突破性提案,旨在从加速审批流程、临床试验管理、生命周期管理和保障创新者权益四个角度鼓励创新。1个月之后,中国正式加入国际人用药品注册技术协调会(ICH)
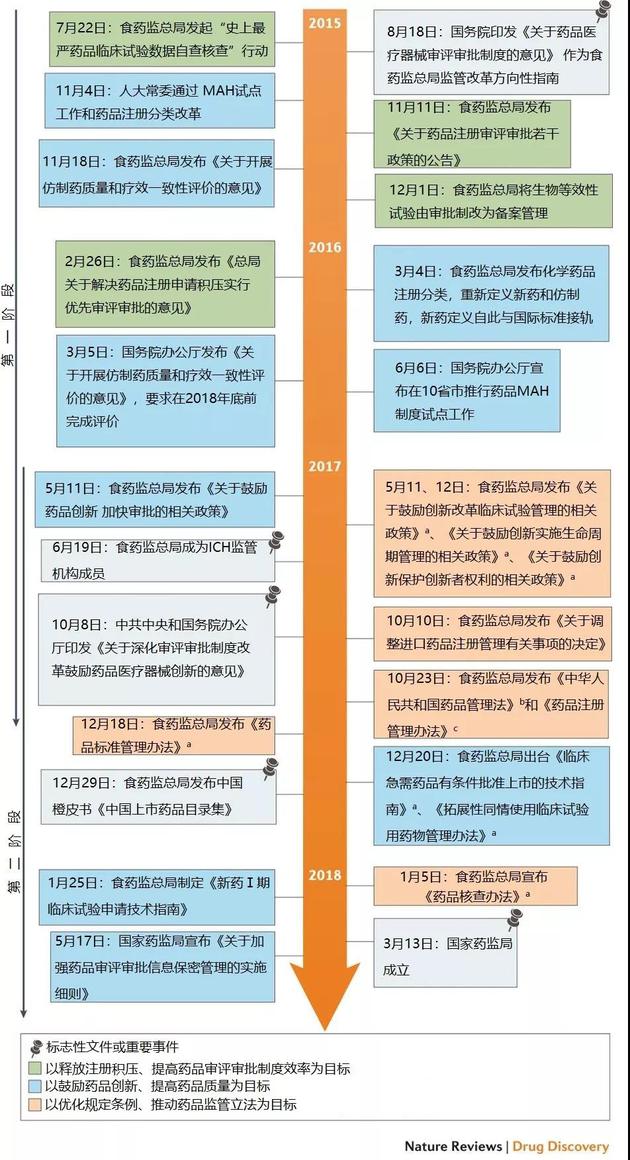 图1:中国药品监管体系改革时间轴。如图所示,改革措施按目标分为三组。CFDA=国家食药监总局;CPC=中国共产党;ICH=国际人用药品注册技术协调会;MAH=药品上市许可持有人;NMPA=国家药品监督管理局;NPC=全国人大。a=征求意见稿。b=草案征求意见稿。c=修订稿。
图1:中国药品监管体系改革时间轴。如图所示,改革措施按目标分为三组。CFDA=国家食药监总局;CPC=中国共产党;ICH=国际人用药品注册技术协调会;MAH=药品上市许可持有人;NMPA=国家药品监督管理局;NPC=全国人大。a=征求意见稿。b=草案征求意见稿。c=修订稿。加入ICH意味着中国市场将进一步向跨国药企以及这些药企研发的新药开放。最终,这将能够让更多中国患者用上创新药。同时,中国本土药企在创新药研发和优质仿制药生产方面也将得到提升。国内药企将遵循同一指南和要求,应对全球性竞争,让创新最终成为企业安身立命的唯一出路。
2017年10月8日,中共中央办公厅、国务院办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,将这轮监管改革推向了高潮。除了2017年5月提出的四条政策以外,食药监总局还要求建立上市药品目录集,建立药品专利链接制度,开展药品专利期限补偿制度试点 ,实施临床试验数据保护体系。许多指南已在特定监管文件中得到落实,部分已正式生效,部分正在征求各方意见。
2017年底正式发布的《中国上市药品目录集》标志着中国改革行动的又一个里程碑。通过借鉴美国食品药品管理局(FDA)的“橙皮书”,中国希望中国版“橙皮书”可以提高公众对上市药品的全面认知,不仅包括基本药品信息,如原料药和制剂,还包括知识产权信息——进一步为专利链接制度奠定了基础,以此鼓励创新药和仿制药研发。
2017年10月10日,食药监总局发布《决定》,宣布调整相关措施以加快进口药品注册。目前已经可以在中国开展多中心I期临床试验。2017年10月23日,食药监总局发布《〈中华人民共和国药品管理法〉修正案(草案征求意见稿)》/《药品注册管理办法(修订稿)》,预计将于2018年正式发布。
文件提出了多项重大改革措施,包括设立优先审评审批制度,临床试验备案制度,药品上市许可持有人(MAH)制度,强化良好实验室实践/良好临床实践。2018年3月13日,新一轮国务院机构改革成立了国家药品监督管理局——作为新组建的正部级单位国家市场监督管理总局的下属机构。
结束语
中国的多项药品监管改革举措已经成功提高了药品质量,让更多患者能接触到最新疗法,推动了医药创新。此外,过去三年来,食药监总局也逐渐转变成一个更加科学、透明的机构。为了更好地应对快速变化的药品研发形势,中国医药行业不断自我调整、重组,向着成为药品研发和上市的全球领先力量前进。

